Types de microscopes à fluorescence
Lorsque les microscopes ont été inventés vers 1600 de notre ère, les philosophes de la nature ont tourné leurs yeux vers un monde dans un monde. Lorsqu'Antony van Leeuwenhoek a conçu de petites lentilles très incurvées et un support mécanique pour ajuster la vue, il a ouvert une fenêtre sur le monde microscopique des bactéries, des cellules sanguines, des protozoaires et de la structure cellulaire des plantes. Mais tout au long de l'histoire de la microscopie, il y a toujours eu une question : quelles sont ces choses étranges vues à travers une lentille ? La microscopie à fluorescence fait référence à un ensemble de techniques qui minimisent cette incertitude, car en microscopie à fluorescence, lorsque la lumière est dirigée sur un échantillon, elle renvoie sa propre lumière.
Épifluorescence

Le microscope à fluorescence le plus courant est de loin la configuration à épifluorescence. Dans un microscope à épifluorescence, une source lumineuse - généralement une lampe au mercure ou au xénon - brille à travers un filtre qui sélectionne une région étroite de longueurs d'onde. La lumière filtrée brille sur l'échantillon à travers l'objectif du microscope. La lumière entrante est absorbée par les fluorophores - des marqueurs moléculaires qui émettent une lumière d'une longue longueur d'onde lorsqu'ils absorbent la lumière d'une longueur d'onde plus courte. La lumière des fluorophores, ainsi que la lumière diffusée par la source d'éclairage, retournent dans la lentille de l'objectif et vers le détecteur ou l'œil. En cours de route, un autre filtre bloque la lumière d'éclairage, il ne reste donc que la lumière fluorescente de l'échantillon.
Confocal
Un microscope à épifluorescence recueille la lumière de partout dans le champ de vision du microscope. Une partie de la lumière d'excitation est absorbée avant le plan focal du microscope, une partie au plan focal et une autre au-delà du plan focal. Parce que le microscope recueille toute cette lumière, l'image contiendra une image nette de la lumière au foyer, mais elle aura également une lumière floue provenant d'autres régions. Un microscope confocal corrige cela en focalisant un point laser dans le même plan que le microscope est focalisé. Ensuite, un trou d'épingle passe devant le détecteur, où il bloque toute la lumière qui ne provient pas du foyer du microscope. En scannant l'échantillon, une image tridimensionnelle nette de l'objet peut être obtenue.
Multiphoton
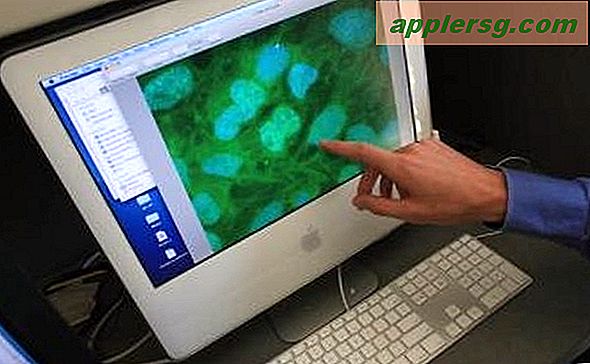
Dans un microscope confocal, l'alignement est très sensible. Si le point laser, l'objectif du microscope, l'optique collectrice et le trou d'épingle sont éteints, même le moins possible, les performances du microscope en pâtissent. Un microscope multiphotonique contourne ce problème en utilisant une longueur d'onde laser qui n'est que la moitié de l'énergie nécessaire pour exciter les fluorophores dans l'échantillon. La seule façon pour les fluorophores de s'exciter et d'émettre de la fluorescence est que la lumière laser soit suffisamment brillante pour que deux particules de lumière - les photons - frappent le fluorophore en très peu de temps. Cela ne se produit que lorsque le laser est focalisé sur un très petit point. Ainsi, le seul endroit de l'échantillon qui émettra de la lumière est celui où le laser est focalisé, ce qui maintient l'image belle et propre car il n'y a pas de lumière de fond supplémentaire à éliminer, ce qui signifie qu'il n'y a pas de trou d'épingle à aligner.
Fluorescence par réflexion interne totale (TIRF)
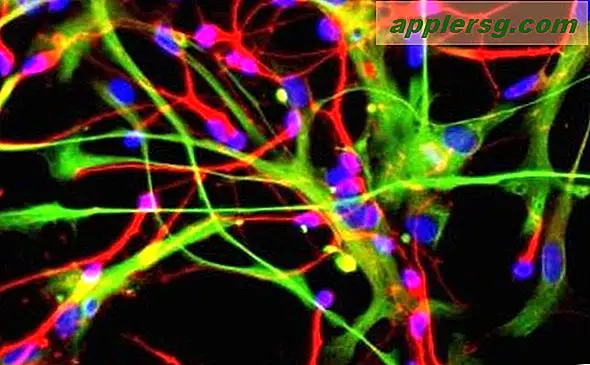
Une autre façon d'obtenir des images très nettes est de s'assurer que la lumière d'excitation ne pénètre pas très loin dans l'échantillon. Si une goutte de neurones, par exemple, est placée dans une goutte de solution sur une lame de verre, alors certains des neurones adhéreront à la surface du verre. Dans un microscope à fluorescence à réflexion interne totale (TIRF), la lumière est dirigée latéralement dans la lame de verre de sorte qu'elle ne pénètre pas vraiment dans la solution contenant les cellules. Mais une partie de la lumière s'infiltre à peine dans la solution - juste très près de la surface du verre. Cela signifie que les seuls endroits qui émettront de la lumière seront dans une région très mince juste contre la surface du verre. Pour quelque chose comme les neurones, où tant de choses intéressantes se produisent à la surface des cellules, cette technique peut être très efficace.
Super-résolution
Tous les microscopes, y compris les microscopes à fluorescence, sont limités par la physique qui régit la propagation de la lumière. L'une des règles de base est qu'un point de lumière focalisé ne peut devenir que si petit - et pas plus petit. Pour la lumière visible, cette taille est d'environ 200 nanomètres, soit 200 milliardièmes de mètre. Mais les molécules individuelles ne mesurent que quelques nanomètres, il y a donc beaucoup de caractéristiques intéressantes qui sont en dessous de cette limite de taille, appelée limite de diffraction. Les scientifiques développent des techniques de « super-résolution » pour contourner cette limite. La microscopie à illumination structurée (SIM) et la microscopie à émission stimulée (STED), par exemple, sont toutes deux des méthodes de microscopie à fluorescence qui limitent la taille du spot électroluminescent en réduisant la taille du spot lumineux d'excitation.












